Avant-propos
Alors que je suis en train d’apporter les dernières corrections à ce travail de maturité, il me tient à cœur de préciser quelques éléments et événements qui ont rythmé cette rédaction. Tout d’abord, j’aurais bien aimé faire un travail où une recherche de terrain aurait été nécessaire. Cependant ce n’est pas le but de ce travail de maturité, en tout cas dans le cadre de ce séminaire, et le fait de se focaliser sur la recherche bibliographique m’a finalement convenu. J’ai beaucoup de plaisir à étudier cette espèce présente dans nos régions mais aussi ailleurs en Europe. Grâce à ce travail, j’ai pu découvrir une autre facette du Merle à plastron, une autre sous-espèce, torquatus (Linnaeus, 1758), qui est par ailleurs la sous-espèce nominale ; mais que l’on connaît moins sous nos latitudes. Cette sous-espèce ressemble en certains points à celle que l’on peut croiser sur les crêtes des Préalpes ou dans les vallées valaisannes mais elle en diffère également sous plusieurs angles. C’est pour cette raison de proximité et d’accessibilité que certaines photos présentées ne concernent pas la sous-espèce étudiée mais plutôt alpestris (C. L. Brehm, 1831), que j’ai eu la chance d’observer en Suisse ainsi que dans les Carpates en Roumanie.
1. Introduction
« Natural selection acts only by taking advantage of slight successive variations ; she can never take a great and sudden leap, but must advance by short and sure, though slow steps. » Charles Darwin, 1859 [1]
Dans sa Théorie de l’Evolution, Darwin précise que les adaptations des espèces se font lentement, étape par étape. C’est la raison fondamentale pour laquelle les changements climatiques des dernières décennies bouleversent les écosystèmes et la biodiversité. En effet, ces modifications se font à grande vitesse et en s’accélérant chaque année considérablement. A tel point que la faune et la flore ne parviennent pas à s’adapter à un tel rythme.
Dans ce contexte, de nombreuses espèces subissent un déclin marqué qui s’accentue à mesure que le réchauffement du climat s’accélère. Cependant, ces disparitions progressives ne sont pas toutes la conséquence dramatique de ces modifications. Certaines d’entre elles sont le triste résultat de comportements humains ou de facteurs anthropiques comme la chasse et l’urbanisation rapide. Mais où se situe la limite entre les facteurs indirects, climatiques et ceux en lien direct avec l’activité d’homo sapiens ?
C’est à travers ce questionnement que ce travail s’inscrit dans le séminaire « Changements climatiques : espèces en danger ? ». En effet, ces dernières décennies, les ornithologues ont remarqué un déclin rapide et nouveau chez le Merle à plastron. Pour combien de temps encore ce turdidé, proche parent du Merle noir fréquentant la pelouse de tout un chacun, lancera-t-il sa douce mélodie du haut d’un petit sapin dominant la lande ? Pour mieux pouvoir comprendre ce déclin, sa biologie, son habitat et ses migrations ont été détaillés. Ce passereau migrateur subit de plein fouet les modifications climatiques récentes, notamment au niveau des précipitations et des températures. Cette étude est concentrée sur ces deux facteurs décisifs dans les deux régions de nidification et d’hivernage.
Le but de ce travail est de déterminer si ce déclin récent est lié ou non aux modifications récentes du climat, et aux conséquences qui en découlent comme une éventuelle concurrence avec d’autres espèces proches. D’autres facteurs plus directement liés aux activités humaines entrent aussi en ligne de compte.
2. Présentation du Merle à plastron Turdus torquatus
a. Description de l'espèce
i. Systématique et répartition
De l’ordre des Passériformes, le Merle à plastron Turdus torquatus (Linnaeus, 1758) appartient à la famille des Turdidés [2] (Gill et Donsker, 2015). L’aire de répartition du Merle à plastron (Figure 1) s’étend à travers l’Europe [3] (Svensson, 2009, p. 296). Elle se divise en trois régions où nichent trois sous-espèces : la sous-espèce nominale torquatus se retrouve en Scandinavie, Angleterre et Irlande. C’est de cette sous-espèce dont il sera question dans ce travail. Elle est remplacée par alpestris (C. L. Brehm, 1831) en Europe centrale alors que amicorum (Hartert, 1923) occupe le sud-ouest de l’Asie et Caucase jusqu’au nord de l’Iran. [4], [5] (Cramp 1988 ; Janiga et Proxton 1997)
Figure 1 : Carte de répartition des trois sous-espèces du Merle à plastron dans le paléarctique occidental.
En rose, les régions où il niche, en orange où il est résident à l’année et en vert les zones d’hivernage de l’espèce.
ii. Morphologie & comportement
Le Merle à plastron est un passereau proche du Merle noir Turdus merula (Linnaeus, 1758), passereau commun des jardins et parcs européens, qui lui ressemble par sa taille et sa silhouette. D’une envergure de 40 centimètres environ pour une longueur de 23 centimètres [6] (Maumary, Valloton et Knaus, 2006, p. 581), il est cependant aisé de le reconnaître grâce à son croissant blanc sur la poitrine. Ce plastron blanc est peu marqué chez la femelle qui est également plus terne que le mâle. Le Merle à plastron se différencie aussi du Merle noir par les liserés pâles se trouvant sur les ailes des mâles, des femelles et des jeunes. Le cercle oculaire jaune caractéristique du mâle de Merle noir est absent chez le Merle à plastron, alors que son bec jaune le différencie de toutes les grives. [7] (Figure 2) (Jonsson, 1993, p. 270 ; Svensson 2009, p. 296).
Figure 2 : Caractéristiques du Merle à plastron (alpestris représenté ici)
La sous-espèce torquatus se distingue d’alpestris par la largeur du blanc autour des plumes sous-caudales et du ventre. En effet, torquatus n’a qu’une très fine frange blanche, voire pas du tout, alors qu’alpestris présente une large bordure blanche [8] (Figure 3). (Demongin, 2013, p. 196) Ce critère est mieux appréciable sur des oiseaux tenus en main mais reste tout de même déterminant sur le terrain. (Svensson, 2009, p. 296)
Figure 3 : Plumes sous-caudales de alpestris (gauche) et torquatus (droite), noter la largeur des
franges blanches ainsi que la tache centrale marquée chez alpestris, alors que celles-ci sont très
discrètes voire absentes chez torquatus.
Son chant est assez variable mais se compose « d’une répétition de 2-4 sifflements flûtés ». Assez farouche, lorsqu’il s’envole comme quand il alarme, il émet un « tack-tack-tack-tack » (Jonsson, 1993, p. 270). Contrairement à d’autres espèces de passereaux, il n'émet que très rarement des cris de contact lors de sa migration.
b. Description de la biologie de l'espèce
i. Reproduction
Les adultes retrouvent leurs sites de nidification dès fin-février (Cramp, 1988) et, dès lors, les mâles se mettent à chanter sur les postes d’observation dominant leur territoire. Ils défendent alors celui-ci ardemment contre tout intrus, ce qui donne même parfois lieu à des combats. (Observation personnelle, Carpates, avril 2013) (Figure 4) Cependant, les couples ne débutent généralement pas la construction du nid avant mi-avril [9] (Sim, 2010, p. 230). Le nid en question est une coupe profonde dont la structure principale est constituée de mousses et de branches sèches de conifères, le tout tenu grâce à un mélange de boue, et d’herbes fines. (Figure 5)
L’emplacement du nid varie selon la région : dans les Alpes, il est le plus souvent localisé sur une grosse branche de conifère (Maumary, Valloton et Knaus, 2006, p. 580), alors que dans la lande anglaise, on le retrouve surtout dans la végétation basse telle que la Bruyère Calluna vulgaris voire même directement sur le sol. (Sim, 2010, p. 230) La femelle pond en moyenne 4 œufs (3-6) bleuâtres et tachetés [10] (Sim, 2010 ; Maumary, Valloton et Knaus, 2006, p. 581 ; Burfield, 2002, p.8) qu’elle couvera seule pendant 12 à 14 jours d’incubation (Burfield, 2002, p. 8). Une fois les œufs éclos, les deux parents assurent le nourrissage des jeunes au nid pendant 11 à 15 jours (Maumary, Valloton et Knaus, 2006, p. 581 ; Brufield, 2002, p. 8), alors que pendant les 2-3 semaines suivant l’envol de ceux-ci, c’est principalement le mâle qui se charge du nourrissage des jeunes voletant pendant que la femelle recommence déjà une deuxième nichée. [11](Appleyard, 1994) Les Merles à plastron atteignent leur maturité sexuelle dès l’année suivant leur naissance et sont, à priori, monogames. (Burfield, 2002, p.8)
ii. Migration
Une fois leur nidification terminée, les Merles à plastron quittent la lande anglaise, la taïga scandinave ou la forêt d’altitude alpine afin de traverser l’Europe et rejoindre l’ouest du bassin méditerranéen (Svensson, 2009, p. 296) où ils hivernent dans les montagnes de l’Atlas (Maroc) ou de la sierra espagnole. (Figure 6)
La plupart des nicheurs anglais sont déjà en route à la fin septembre et arrivent ainsi sur leurs lieux d’hivernage dès mi-octobre. (Sim, 2010, p. 2) Le passage sur l’Europe centrale est discret et les observations sur le plateau suisse par exemple sont rares et résultent souvent de chutes de neige en mars-avril qui forcent les oiseaux déjà présents sur leurs sites de nidification à descendre en plaine afin de trouver de quoi se rassasier. (Maumary, Valloton, Knaus, 2007, p. 580)
Quelques observations hivernales sont notées pratiquement chaque année en Angleterre et en Suisse notamment. [12] (Maumary, Valloton, Knaus, 2007, p. 579 ; British Trust for Ornithology, 2012)
La migration prénuptiale débute dès fin janvier. Les Merles rejoignent alors leurs lieux de nidification par les mêmes axes que pour la migration postnuptiale. Ils arrivent en Angleterre dès fin-février pour y débuter leurs chants et parades. (Cramp, 1988)
iii. Régime alimentaire
Principalement insectivore lors de la nidification, le Merle à plastron se nourrit principalement de baies lors de son hivernage en Afrique du Nord. Il nourrit ses jeunes principalement de lombrics Lumbricidae mais également d’insectes comme des criquets, des chenilles, des scarabées, des libellules et des fourmis qu’il capture non seulement en bordure de forêt mais surtout dans les pâturages en se baladant au sol par petits bonds. Il lui arrive également de compléter son régime alimentaire avec des gastéropodes, voire même des Lézards vivipares Lacerta vivipara (Von Jacquin, 1787) ou des Salamandres noires Salamandra atra (Laurenti, 1768). (Maumary, Valloton et Knaus, 2006, p. 580) (Figure 7) Hors saison de reproduction, il complète ou remplace même ce régime insectivore par un régime frugivore. Il mange alors principalement des baies de Genévrier commun, mais également de Sorbier des oiseleurs, de Myrtille, d’Airelle rouge, de Framboisier, d’Alisier petit néflier, de Sureau noir, de Rosier, etc. Il cueille toutes ces baies surtout directement sur l’arbuste en question mais aussi à terre lorsque celles-ci sont tombées. (Maumary, Valloton et Knaus, 2006, p. 580)
Figure 7 : Merle à plastron Turdus torquatus torquatus posé sur un Genévrier commun Juniperus communis
transportant la becquée pour ses petits, constituée notamment d’un Lombric Lumbricidae et d’une Chenille.
c. Description de l'habitat
i. Habitat de nidification
En Angleterre, le Merle à plastron occupe un milieu de nidification relativement différent de celui de la sous-espèce alpestris dans les Alpes, où elle niche dans les forêts claires de conifères, avec une préférence pour les zones d’arbres rabougris, de coupes forestières ainsi que les bois comprenant de nombreuses clairières. [13] (Caula, 2011, p. 178) Torquatus niche dans « les vallées abruptes et les ravines, particulièrement où l’on trouve des rochers et des éboulis ». (Sim, 2007, p. 149) (Figure 8) Mais il niche aussi dans des zones plus plates comme des landes. Ces milieux typiques du paysage anglo-saxon se trouvent généralement entre 250 et 1150 (Burfield, 2002, p. 8) voire 1200 mètres d’altitude [14] (Royal Society for the Protection of Birds). Cependant, quelques nidifications ont été prouvées à de basses altitudes, proches du niveau de la mer. (Burfield, 2002, p. 8) Les habitats comprennent en principe une couverture de Bruyère ou une mosaïque de Bruyère et d’herbe [15] (Sim, 2007, p.375 ; Burfield, 2002, p.8), où parfois se trouvent quelques arbres isolés.
Figure 8 : Milieu de nidification typique du Merle à plastron en Angleterre, noter la couverture idéale
de Bruyère et Myrtille et la présence indispensable de zones dépourvues de végétation.
Cet attrait pour les milieux ouverts et non-forestiers caractérise le Merle à plastron et c’est un des éléments qui font de lui un cas à part parmi les grands turdidés. (Burfield, 2002, p.8) De plus, la présence de parcelles d’herbes rases dans le territoire de nidification semble être un facteur important pour la recherche de nourriture, principalement de Lombrics, lors du nourrissage des jeunes notamment. [16] (Arnaud Barras, entretien personnel)
ii. Habitat d'hivernage
Entre fin octobre et début novembre, après avoir traversé l’Europe et la Méditerranée, la majeure partie de la population migratrice de Merles à plastron rejoint les Monts Atlas, au Maroc, pour y passer l’hiver. (Burfield, 2002, p. 9)
Les milieux que le Merle à plastron fréquente dans ces reliefs sont des milieux boisés où se trouvent, en densité faible, l’Oxycèdre ou Genévrier cade Juniperus oxycedrus, type de genévrier que le Merle à plastron apprécie particulièrement et qui constitue ainsi la majeure partie de son régime alimentaire pendant la période hivernale.
Ces bois de genévriers (Figure 9) sont « dégradés et vieillissants » [17] (Ryall et Briggs, 2006, p. 1) et leur régénération semble compromise, à cause notamment des coupes forestières et du surpâturage mais aussi de la sécheresse. (Ryall et Briggs, 2006, p.1 et p.9)
Figure 9 : Genévriers oxycèdres Juniperus oxycedrus dans un milieu semi-boisé du Haut-Atlas au Maroc.
Le Genévrier cade se retrouvent notamment dans les Monts Atlas, du niveau de la mer jusqu’à près de 2000-2200 mètres d’altitude [18] (Quézel, 2010, p. 3016-3023). C’est donc dans cette tranche d’altitude que s’observent la majorité des Merles à plastron.
Contrairement à l’été, où le Merle à plastron se nourrit d’insectes et autres invertébrés, la présence de parcelles d’herbes rases n’est pas nécessaire et il fréquente alors plus volontiers des milieux boisés qu’en été. Cependant, ces milieux semi-boisés souffrent souvent d’un sol dénudé par le surpâturage. (Ryall et Briggs, 2006, p.9)
Ce surpâturage est étroitement lié à la tradition berbère marocaine. C’est un phénomène très important et décisif pour la biodiversité dans les montagnes marocaines. Pour avoir un ordre d’idée, près de 800'000 moutons paissent dans les quelques 500 km2 du Parc naturel d'Ifrane, situé dans le Moyen-Atlas, au nord-est du Maroc. En théorie, cet immense troupeau devrait être quatre fois inférieur pour respecter les forêts précieuses pour la biodiversité. [19] (Tarrier, 2005)
c. Présentation de l’évolution de ses effectifs au cours des dernières décennies
Une augmentation considérable du nombre d’observations hivernales est à noter en Angleterre entre 1981-1984 et 2007-2011 (Figure 10). (British Trust for Ornithology) Fait intéressant à relever, la majeure partie de ces observations hivernales se concentrent sur le littoral et à basse altitude. De plus, elles sont inégalement réparties sur la façade est et la façade atlantique. Très peu de ces observations sont notées sur cette dernière. Cela est dû au climat plus doux et sec de ces régions, comme décrit ci-dessous.
Figure 10 : Genévriers oxycèdres Juniperus oxycedrus dans un milieu semi-boisé du Haut-Atlas au Maroc.
Pour ce qui est de l’évolution des nicheurs, la tendance est inverse. En effet, une diminution assez nette se remarque dans la plupart des secteurs du Royaume-Uni, et ce apparemment depuis la première moitié du XXème siècle. [20] (Beale, 2006, p.2) Ce déclin a abouti à réduire la population nicheuse d’Angleterre à quelque 6’900 (6’200-7’500) couples (British Trust for Ornithology, Royal Society for the Protection of Birds). Cette population représente ainsi seulement environ 2% de la population européenne, qui est constituée de 185'000 à 570'000 couples nicheurs. (British Trust for Ornithology)
Il n’existe malheureusement pas de données chiffrées pour les années précédant le déclin, et il n’est donc possible de comparer les effectifs qu’à l’aide de cartes de répartition. En certaines localités la population nicheuse de Merles à plastron a même presque totalement disparu. C’est le cas notamment des populations de l’Exmoor National Park, de Glen Callater (Cairngorms National Park) et Long Mynd (Shropshire Hills) (Figure 11, à gauche), étudiées par les membres du « Ring Ouzel Study Group [21] ». (Sim, 2010, p. 4) (Figure 12)
Comme le montre la Figure 13, ce déclin est généralisé dans l’ensemble du Royaume-Uni et dans certaines régions on ne trouve plus de Merle à plastron en période de nidification. Cependant, parallèlement à ce déclin, une seule population, celle de Glen Effolk (Cairngorms National Park) a vu ses effectifs augmenter significativement au cours des cinq dernières années (Figure 14). Les raisons de cette augmentation ne sont pas certaines mais sont sûrement en relation avec une augmentation récente des troupeaux de moutons, agrandissant ainsi les surfaces des parcelles d’herbes rases, favorables à la recherche de Lombrics. (Sim, 2010, p. 4)
Il ne s’agit cependant que d’un cas à part qui ne peut que confirmer le vieil adage « c’est l’exception qui confirme la règle ». Mais ce cas à part représente également un espoir pour la conservation du Merle à plastron. En effet, s’il est avéré que cette population se porte bien à cause des éléments cités ci-dessus, il s’agirait d’un exemple à suivre. (Sim, 2010, p.4)
2. Présentation du climat dans les régions considérées
a. Climat en Angleterre
i. Dernières décennies
Comme dans la grande majorité des régions du monde, le climat a passablement changé en Angleterre, et ce autant sur le plan des précipitations que de la température. Les données présentées ici représentent des moyennes sur des périodes relativement longues et ne mettent donc pas parfaitement en exergue les conditions extrêmes de certaines des dernières années. Cependant, ce sont ces données qui sont traitées ici car elles proviennent d’une source officielle et sûre. La moyenne annuelle des températures maximales est passée de 11.8°C pour la période de 1961 à 1990 à 12.4°C entre 1981 et 2010, traduisant ici une augmentation significative de 0.6°C en l’espace de deux décennies. [22] (Met Office, 2015) De plus, la moyenne des températures minimales a elle aussi augmenté de 0.5°C (4.8°C à 5.3°C) dans le même intervalle de temps. (Met Office, 2015) (Figure 15) Cette augmentation est répartie d’une façon assez homogène dans l’année ; une augmentation plus faible voire même une diminution de la température est tout de même à noter pour les mois de juin, octobre ainsi que décembre.
Figure 15 : Tableau de comparaison des températures moyennes maximales et minimales entre 1961-1990
et 1981-2010 au Royaume-Uni, toutes les valeurs sont en [°C].
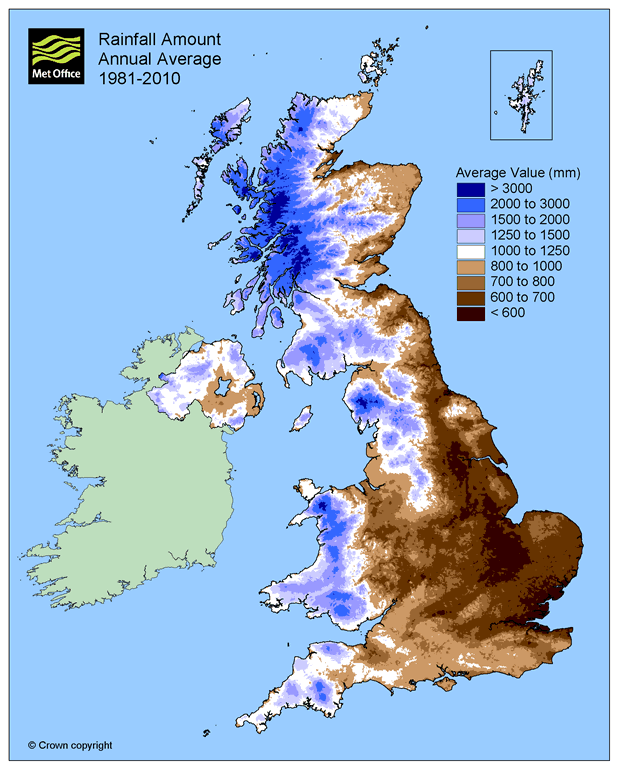
Parallèlement à cette augmentation des températures, une baisse du nombre de jours de gel par année est notée. Cette baisse n’est pas négligeable puisqu’elle est de 6 jours (60 à 54). En ce qui concerne les précipitations, une augmentation est aussi à remarquer. Elle se traduit par un passage d’une moyenne annuelle de 1100.6 mm pour la période de 1961 à 1990 à une moyenne de 1154 mm pour celle de 1981 à 2010, soit une augmentation de 53.4 mm. Il est intéressant de noter que la moyenne des précipitations n’a pas augmenté d’une façon homogène sur l’ensemble de l’année. En effet, les précipitations se sont principalement accrues en automne et hiver avec des valeurs allant jusqu’à +15.2 mm en moyenne pour octobre alors qu’au printemps et en été cette augmentation est plus faible, il y a même une diminution pour les mois de mai, août et septembre. (Figure 16) (Met Office, 2015)
Les précipitations se concentrent principalement sur la face atlantique du Royaume-Uni, notamment en Ecosse alors que les régions plus sèches se trouvent au Sud-Est. (Figure 17) Ceci s’explique par le fait que les perturbations arrivant de l’océan Atlantique rencontrent là leur premier obstacle et viennent donc « s’écraser » sur ces reliefs. En conséquence, l’augmentation des précipitations est d’autant plus marquée en Ecosse où elle atteint des valeurs de près de +100 mm en moyenne en 20 ans. (Met Office, 2015) Finalement, la durée d’ensoleillement n’a pratiquement pas varié en 2 décennies alors qu’une augmentation de 2 jours (154 à 156) avec des précipitations supérieures à 1 mm par année se fait remarquer. (Met Office, 2015)
ii. Projections envisagées
Pour ce qui est des températures, les prévisions envisagées varient, pour les plus optimistes, d’une augmentation de 2°C en moyenne pour le Royaume-Uni à, pour les plus pessimistes, une hausse de 5°C en moyenne d’ici 2080. (Met Office, 2015) En effet, les estimations les plus vraisemblables tablent sur une augmentation progressive d’environ 1°C par période de 30 ans (2020, 2050 et 2080) pour arriver, en 2080, à une augmentation de 3.5°C en moyenne. (Figure 18) Il est intéressant de remarquer que cette hausse serait plus marquée sur la partie la plus continentale des îles britanniques alors qu’elle serait moindre sur la façade atlantique et plus précisément au nord. Cela s’explique par le fait que les écarts de températures sont plus faibles dans les régions sous influence de climat océanique. Or, ce climat océanique est plus marqué sur la côte atlantique alors qu’il laisse progressivement la place au climat océanique altéré puis continental en direction de l’intérieur du continent européen. [23] (MeteoFrance, 2016) Dans les régions à climat océanique altéré, les écarts de température sont plus marqués. C’est le cas pour la région sud-est de l’Angleterre.
Figure 18 : Projections de hausse des températures moyennes
au Royaume-Uni d’ici 2020, 2050 et 2080 (de gauche à droite).
Pour ce qui est des précipitations, les projections vont d’une baisse de 10% à une hausse de 10% en moyenne. Les estimations moyennes (Figure 19) prévoient plutôt une augmentation à court terme des précipitations, soit d’ici 2020, principalement pour les régions de l’intérieur des terres alors qu’une baisse est envisagée pour les régions côtières. A plus long terme, l’augmentation se réduirait principalement au sud et à l’est du Royaume-Uni alors que la façade atlantique subirait plutôt une diminution des précipitations. Cela s’explique également par l’influence du climat océanique qui diminue en se rapprochant de l’intérieur du continent. En effet, les précipitations sont plus abondantes là où le climat océanique est très influent. (MeteoFrance, 2016)
Figure 19 : Projections d’évolution des précipitations moyennes
au Royaume-Uni d’ici 2020, 2050 et 2080 (de gauche à droite).
Gilles Hauser
Collège St-Michel
Travail de maturité
Mars 2016
Le déclin récent du Merle à plastron Turdus torquatus en Angleterre

Plumes sous-caudales

Plumes sous-caudales


Observations hivernales (points bleus) au Royaume-Uni en 1981-1984

Observations hivernales (points bleus) au Royaume-Uni en 2007-2011

Localisation des différentes populations étudiées par les membres du « Ring Ouzel Study Group ».
![Tableau de comparaison des températures moyennes maximales et minimales entre 1961-1990 et 1981-2010 au Royaume-Uni, toutes les valeurs sont en [°C].](https://static.wixstatic.com/media/163882_a97bf7f576664f83a216d18efa22f89c~mv2.png/v1/fill/w_648,h_275,al_c,q_85,usm_0.66_1.00_0.01,enc_avif,quality_auto/163882_a97bf7f576664f83a216d18efa22f89c~mv2.png)

Répartition du Merle à plastron nicheur (points oranges) en Angleterre

Répartition du Merle à plastron nicheur (points oranges) en Angleterre











![Tableau de comparaison des précipitations moyennes au Royaume-Uni entre 1961-1990 et 1981-2010, toutes les valeurs sont en [mm].](https://static.wixstatic.com/media/163882_3420b4d84bee4e6f8968de21201b4f54~mv2.png/v1/fill/w_424,h_278,al_c,q_85,usm_0.66_1.00_0.01,enc_avif,quality_auto/163882_3420b4d84bee4e6f8968de21201b4f54~mv2.png)